
卵巢癌是一种常见的妇科恶性肿瘤,我国每年新发病例约5.5万例,每年死亡人数达3.7万例[1-2]。经传统手术和含铂化疗治疗后,仅40%的患者生存期超过5年[3]。多项研究证实聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂维持治疗可以显著延长新诊断或铂敏感复发性卵巢癌患者的生存期,已经成为卵巢癌治疗的新模式。随着PARP抑制剂的广泛应用,药物相关的不良反应也备受关注。PARP抑制剂的不良反应包括血液毒性、消化道毒性、神经毒性等,每种药物还有其特定的毒性反应。管理PARP抑制剂导致的不良反应有助于提高患者药物治疗依从性,进而改善患者的临床结局。
卵巢癌治疗药物的种类多,不同药物的不良反应特征不同。因此,在卵巢癌不良反应管理期间,建立多学科联合诊疗模式一方面有利于跨学科交流与发展,促进医疗资源优化配置;另一方面有助于减少时间和人力成本,把握最佳治疗时机,制定规范化、个体化的最优处置方案。为此,基于PARP抑制剂不良反应的特点,中国抗癌协会妇科肿瘤专业委员会牵头,邀请国内血液科、消化内科、心血管内科、精神医学科、康复科、药剂科、中医妇科以及肿瘤内科多位专家共同拟定本共识。针对国内已经获批上市的PARP抑制剂导致不良反应的发生率、严重程度分级标准以及防治措施进行讨论和总结,旨在为临床医生提供切实可行的科学指导,使患者治疗获益最大化。
1 PARP抑制剂及其药学特性
1.1 PARP抑制剂作用机制 正常情况下,人体细胞产生的大量DNA单链断裂可通过PARP介导的碱基切除修复(base-excision repair, BER)途径修复[4-5]。DNA双链断裂的主要修复途径为非同源末端连接(Non-homologous end joining,NHEJ)修复和同源重组修复(homologous recombination repair,HRR),前者速度快,但是会发生修复错误,导致基因组不稳定性;后者精确度高,修复后的DNA具有高保真性[6]。PARP抑制剂利用“合成致死”机制杀伤肿瘤细胞:通过抑制PARP酶催化活性和PARP捕获,使DNA单链断裂无法修复并大量堆积,进而产生大量的DNA双链损伤;当细胞存在同源重组修复缺陷(homologous recom? bination de?ciency,HRD)时,DNA双链断裂无法修复或者依赖容易错配的NHEJ途径修复[7],二者作用叠加,增加细胞死亡。
1.2 PARP抑制剂药学特性 不同PARP抑制剂的药学特性不同,一般情况下,PARP抑制剂可以空腹也可以随餐服用。除尼拉帕利通过羧酸酯酶代谢以外[8],其他PARP抑制剂均通过细胞色素P450酶促途径(CYP)代谢[8-10],其中,帕米帕利与强、中、轻效CYP3A抑制剂合用无需调整剂量,奥拉帕利和氟唑帕利应避免与CYP3A4中、强抑制剂或中、强诱导剂合用,如必须合用,需根据具体情况调整剂量。目前,国家药品监督管理局(NMPA)批准的4种PARP抑制剂药学特性见表1。
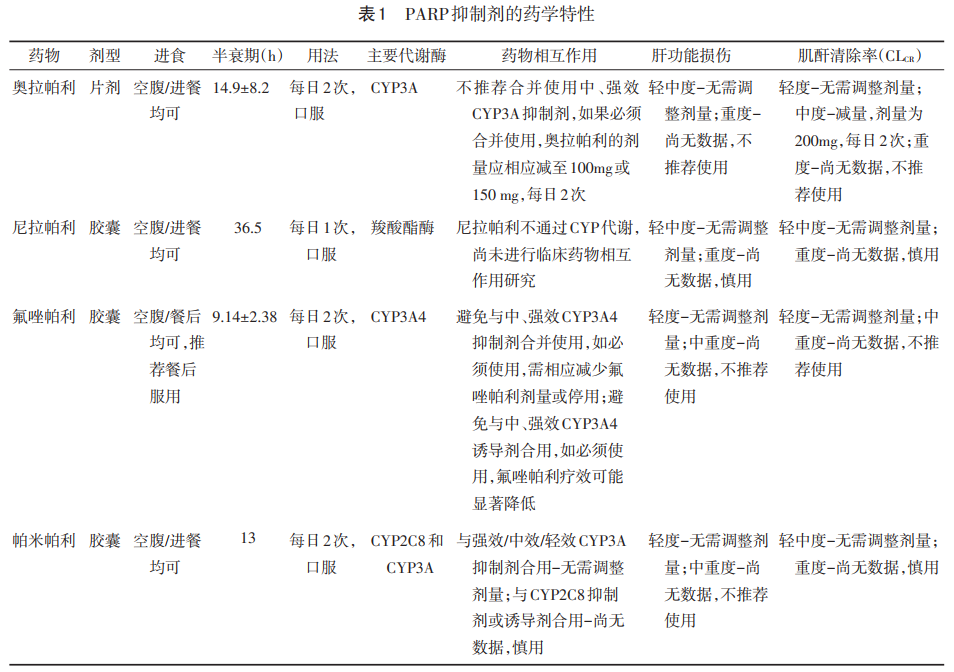
1.3 PARP抑制剂获批情况 2014年,世界首个PARP抑制剂奥拉帕利获得美国食品药品监督管理局(FDA)批准用于治疗卵巢癌。目前为止,FDA和NMPA已批准多种PARP抑制剂应用于临床,中国获批情况见表2。

2 PARP抑制剂不良反应与管理
PARP抑制剂不良反应可能与药物在靶效应(on-target effect)和脱靶效应(off-target effect)相关,特点如下:
(1)不同PARP抑制剂的不良反应特征相似,但不同药物具体的不良反应发生率、严重程度等存在各自特征[11]。在绝大多数药物相关的不良反应处理上,不同药物可以遵循相同的处理原则,但某药物独有的不良反应应该采取独特的处置措施。
(2)轻度或中度不良反应,即不良反应通用术语标准(common terminology criteriafor adverse events,CTCAE)1~2级更为多见,患者耐受性高于化疗(严重程度分级见表3)。

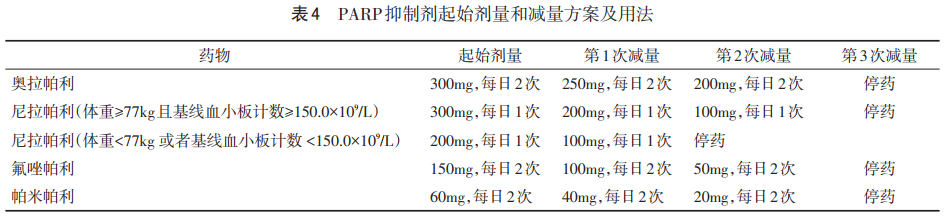
(3)不良反应具有明显的剂量相关性,大部分不良反应可以通过暂停治疗、减量、对症治疗等方法得到控制;尼拉帕利还可以通过个体化起始剂量的给药方式来降低不良反应发生率,同时不对药物治疗效果产生影响,该给药方式已经获得NMPA批准。PARP抑制剂推荐起始剂量及减量方案详见表4。
(4)大部分不良反应出现在开始服药的前3个月,之后毒性症状逐渐缓解。
(5)血液学不良反应、胃肠道不良反应以及疲劳最常见。大部分3~4级不良反应为血液学不良反应,是导致减量、中断和停止用药的最主要原因,0~12%的患者因不良反应而终止用药,大部分患者可长期用药维持治疗。奥拉帕利终止治疗的患者比例为5.9%~12%;尼拉帕利为4%~12%;氟唑帕利为0.9%~1.2%;帕米帕利为0~2.2%。上述数据引自各药物的主要临床研究报道数据,奥拉帕利SOLO1[12]、SOLO2[13]、Study19[14]研究;尼拉帕利NOVA[15]、NORA[16]、PRIMA[17]研究和尼拉帕利胶囊说明书;氟唑帕利FZOCUS-3[18]和FZOCUS-2[19]研究;以及帕米帕利BGB-290-102[20]、BGB-290-AU-002[21]、BGB-290-201[22]、帕米帕利胶囊说明书。下文将不再赘述。
2.1 PARP抑制剂血液学不良反应 PARP抑制剂血液学不良反应包括贫血、血小板减少、中性粒细胞减少等。此类不良反应在治疗前3个月更常见,随着时间的推移会逐渐恢复,有时需要中断或减少PARP抑制剂剂量。PARP抑制剂治疗的第1个月应每周监测全血细胞计数,治疗第1年每月监测,之后定期监测。如发生因3或4级血液学不良反应导致的暂停治疗,在恢复用药后,考虑每周监测全血细胞计数,直到恢复至正常水平[23]。
2.1.1 贫血 血液学不良反应是PARP抑制剂最主要的不良反应之一,其中贫血最常见。PARP抑制剂可靶向作用于PARP1、PARP2、PARP3和PARP13,PARP除参与DNA修复外,在其他生理过程中也起到重要作用,PARP1调节骨髓或血液系统的细胞分化[24],PARP2在调节红细胞生成过程发挥作用[25],因此PARP抑制剂可能与贫血发生相关。研究表明,PARP2缺失会损伤小鼠红系细胞分化,增加溶血反应,导致贫血[26]。贫血如果得不到有效治疗,会导致多脏器缺血缺氧性改变和免疫力降低,加剧疾病进展影响预后,严重影响患者生存质量。PARP抑制剂的贫血总体发生率为21%~70.8%,≥3级发生率为5.9%~35.6%。奥拉帕利贫血发生率21%~46%,3~4级贫血发生率约为5.1%~22%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率50.1%~70.8%,3~4级发生率25.3%~35.6%;个体化起始剂量用药人群(200mg或300mg,每日1次)总体发生率49.7%~53.1%,3~4级发生率14.7%~22.5%;氟唑帕利总体发生率为58.7%~64.6%,3~4级发生率25.1%~32.7%;帕米帕利总体发生率为69.1%,3~4级发生率34.7%;多数贫血患者可表现为头昏耳鸣、体倦乏力、心悸气短、食欲不振及面色萎黄或苍白等症状和体征。
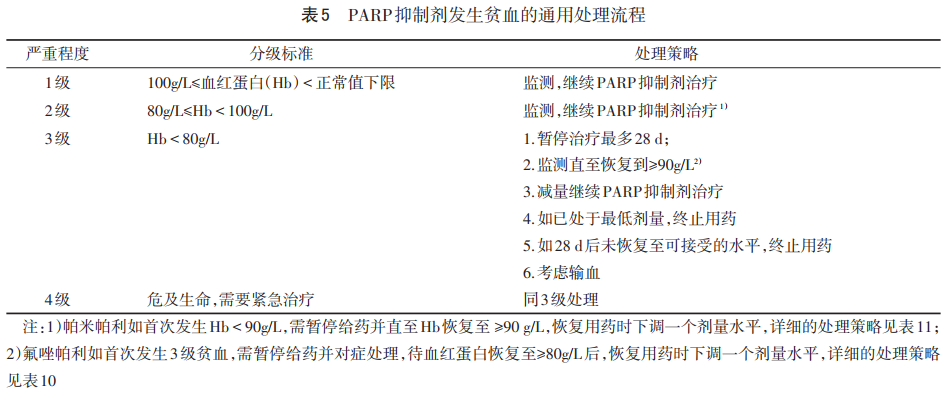
2.1.1.1 贫血处理流程 贫血通常出现在PARP抑制剂治疗的前3个月,可在治疗初期发生,也可缓慢进行性发生。大多为轻中度(1~2级),根据患者潜在耐受性不同,可现不同程度贫血,仅少数患者因贫血中断或减量治疗(见表5)。
2.1.1.2 贫血的治疗
(1)处理原则:不主张输血作为纠正贫血的首选治疗手段。在排除铁、维生素B12、叶酸缺乏和甲状腺功能减退导致的贫血后,1~2级贫血除在监测下继续治疗外,也可以考虑短期中断PARP抑制剂治疗并配合铁剂和叶酸补充剂,有助于贫血恢复。≥3级贫血或伴合并症的患者,建议暂停PARP抑制剂治疗,并考虑支持性疗法,如输血治疗,贫血恢复后再继续PARP抑制剂治疗[27]。常规治疗无效建议转至血液科治疗或组织多学科诊疗(MDT)。
(2)输血治疗:对于无症状、无明显合并疾病的患者不建议输血治疗,可做定期再评价[23]。美国血库协会(AABB)建议Hb<70g/L的贫血患者或者近期化疗或放疗伴有Hb快速下降的高风险人群的无症状人群,或者合并心脏病、脑血管疾病等患者考虑输血治疗。Hb<60g/L或临床急需纠正缺氧状态时考虑输血治疗。
(3)促红细胞生成治疗:红细胞的生成受促红细胞生成素(EPO)的调控,已有研究证实促红细胞生成素能够改善贫血症状以及降低肿瘤化疗患者对输注浓缩红细胞的需要。鉴于EPO使用存在增加血栓栓塞风险和增加肿瘤进展或复发的风险,以及缩短乳腺癌、非小细胞肺癌、头颈癌、淋巴瘤和子宫颈癌患者总生存期,建议在血液科指导下规范使用EPO。EPO给药方法:EPO 150 U/kg或10 kU每周3次,或36 kU每周1次,皮下注射,1个疗程4~6周;如果治疗无反应,建议增加剂量至300 U/kg或20 kU每周3次,或36 kU每周2次皮下注射,并根据情况补充铁剂[28]。
(4)补充铁剂治疗:贫血患者应常规查铁蛋白、维生素B12、叶酸等。绝对性缺铁患者(铁蛋白≤30 µg/L且转铁蛋白饱和度<0.2),须补铁治疗,补充铁剂的方法主要为口服(如硫酸亚铁、富马酸亚铁、葡萄糖酸亚铁、琥珀酸亚铁和乳酸亚铁)和肠道外补充铁剂(如蔗糖铁、低分子量右旋糖酐铁和葡萄糖酸亚铁)。
2.1.2 血小板减少 血小板由成熟的巨核细胞(MKs)形成,PARP1在巨核细胞谱系中表达,对造血干细胞具有调节作用。PARP抑制剂通过抑制PARP1,减少血小板形成[29]。血小板减少发病隐匿,可表现为轻至无症状血小板减少或皮肤黏膜出血,严重者可表现为内脏出血甚至致命性颅内出血。PARP抑制剂导致血小板减少的总体发生率为16%~61.3%,3~4级血小板减少的发生率为<1%~33.8%。奥拉帕利总体发生率16%~18%,3~4级发生率小于1%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为61.3%,3~4级发生率为33.8%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为54%~54.8%,3~4级发生率为11.3%~21%;氟唑帕利总体发生率为42.5%~50.3%,3~4级发生率为12.4%~16.8%;帕米帕利总体发生率为31.9%,3~4级发生率为7.3%。
2.1.2.1 血小板减少的处理流程 血小板减少通常出现在治疗的第1个月,在第2或3个月后逐渐呈恢复趋势,大多数为轻中度,即1~2级。血小板减少处理的通用流程见表6。

2.1.2.2 血小板减少的治疗
(1)处理原则:建议关注患者口腔黏膜和消化道出血状况,避免因血小板过低引起致命性出血[30],并根据血小板减少程度进行相应治疗。常规治疗无效建议转至血液科治疗或MDT。
(2)输注血小板治疗:当血小板<10.0×109/L或有出血风险时,需输注血小板[31]。在规范输注血小板的前提下,有必要使用促血小板生长细胞因子来减少血小板输注带来的相关问题。
(3)促血小板生成因子治疗:促血小板生长因子有重组人白细胞介素11(recombinant humaninterleukin 11,rhIL-11)、重组人血小板生成素(recombinant human thrombopoietin,rhTPO)和TPO受体激动剂,包括罗米司亭(Romiplostim)、艾曲泊帕乙醇胺片、马来酸阿伐曲泊帕片和海曲泊帕乙醇胺片等。目前rhTPO和rhIL-11被NMPA批准用于治疗肿瘤相关的血小板减少症。美国国立综合癌症网络(NCCN)造血生长因子临床实践指南2021年第3版推荐血小板减少患者可考虑接受TPO受体激动罗米司亭治疗[32]。艾曲泊帕乙醇胺片、马来酸阿伐曲泊帕片和海曲泊帕乙醇胺片未见相关前瞻性研究报道。
(4)促血小板生成因子给药方法:重组人血小板生成素rhTPO给药方案:300U/kg·d,皮下注射,每天1次,连续使用7d后检查血小板计数,如治疗无反应,继续使用最长14d,使用超过14d或血小板≥100.0×109/L或血小板较用药前升高50.0×109/L时,应及时停药。rhIL-11给药方法:50 μg/kg,皮下注射,每天1次,连续使用7d后检查血小板计数,如治疗无反应,继续使用最长14d,使用超过14d或至血小板≥100.0×109/L时停药。罗米司亭给药方法:每周1次皮下注射,剂量从1 µg/kg开始,每周增加不超过1 µg/kg,使血小板计数达到和维持50.0×109/L,根据说明书,每周最大给药剂量为10 µg/kg。艾曲泊帕乙醇胺片给药方法:50mg,每日1次,饭前1h或饭后2h服药,2~4周评价疗效。马来酸阿伐曲泊帕片给药方法:40mg,每日1次,口服与食物同服,2~4周评价疗效。海曲泊帕乙醇胺片给药方法:建议初始剂量为2.5mg,每日1次,空腹口服,避免与餐同服,监测并根据血小板计数情况,采用能使血小板计数达到并维持50.0×109/L的最低剂量,最高剂量不可超过每日7.5mg。
2.1.3 中性粒细胞减少 PARP抑制剂导致中性粒细胞减少的可能发生机制与捕获PARP1抑制髓样祖细胞生长[24]有关,还与粒细胞DNA损伤修复能力下降相关[33]。严重的中性粒细胞减少会增加侵袭性感染发生风险,且感染发展迅速,可能仅表现为发热等非特异性表现,严重者可导致脓毒症、感染性休克、甚至死亡。PARP抑制剂导致中性粒细胞减少的总体发生率为16%~58.8%,≥3级发生率为3.7%~26.8%。奥拉帕利总体发生率为16%~23%,3~4级发生率为3.7%~9%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率30.2%~45%,3~4级发生率19.6%~24.4%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率36%~58.8%,3~4级发生率15%~20.3%;氟唑帕利总体发生率为42.5%,3~4级发生率为10.6%~12.6%;帕米帕利总体发生率为50.8%,3~4级发生率为26.8%。
2.1.3.1 中性粒细胞减少的处理流程 中性粒细胞减少通常出现在治疗的前3个月,大多数为轻中度,即1~2级,治疗期间应监测全血细胞计数。中性粒细胞减少处理的通用流程见表7。

2.1.3.2 中性粒细胞减少的治疗
(1)处理原则:不建议使用粒细胞集落刺激因子(G-CSF)预防中性粒细胞减少[34],不推荐长效聚乙二醇化重组人粒细胞刺激因子注射液(PEG-rhG-CSF)治疗性应用。常规治疗无效建议转至血液科治疗或MDT。
(2)治疗方法:3或4级中性粒细胞减少伴或不伴发热均可考虑使用短效重组人粒细胞集落刺激因子(rhG-CSF),并暂停PARP抑制剂治疗。rhG-CSF每日剂量和使用次数请参考相关产品说明书,给药直到中性粒细胞计数恢复至≥1.0×109/L或达到相关PARP抑制剂要求值(请参考表8~11)。伴发热者待发热消退后足够时间(比如48~72h),方可继续PARP抑制剂治疗[35]。4级发热性中性粒细胞减少症,应开始使用抗生素预防感染[27]。




2.2 PARP抑制剂非血液学不良反应 PARP抑制剂非血液学不良反应包括胃肠道毒性、神经系统毒性、心血管毒性等。此类不良反应一般发生在开始治疗的前4~8周,较为短暂,绝大部分患者可以通过症状管理而无需暂停给药或减量。常规治疗无效建议转至相关科室治疗或MDT。PARP抑制剂非血液学不良反应处理的通用流程见表12。

2.2.1 胃肠道毒性
2.2.1.1 恶心、呕吐 恶心和呕吐是PARP抑制剂最常见的消化系统不良反应。恶心发生率相对较高,总体发生率约为44%~73.6%,≥3级发生率≤3%。奥拉帕利总体发生率为44%~73%,3~4级发生率为1%~2%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为73.6%,3~4级发生率为3.0%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为53%~53.1%,3~4级发生率为0~1%;氟唑帕利总体发生率为57.5%~65.5%,3~4级发生率为0~0.6%;帕米帕利总体发生率为61.2%,3级为1.6%,无4级发生。PARP抑制剂呕吐的总体发生率为17%~40%,≥3级发生率<2.7%。奥拉帕利总体发生率为34%~40%,3~4级发生率为1.0%~2.2%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为34.3%,3~4级发生率为1.9%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为17%~32.2%,3~4级发生率为0~2.3%;氟唑帕利总体发生率为25.1%~33.6%,3~4级发生率为0~2.7%;帕米帕利发生率为36.6%,3级为2.5%,无4级发生。恶心、呕吐通常为轻中度。恶心多发生在治疗的早期,第1~2个治疗周期较为严重,通常无需治疗,随后症状逐渐消失。
▲恶心和呕吐处理原则:可预防性使用止吐药物,但因PARP抑制剂每天服用,应避免长期使用类固醇,可在急性病例中短期使用[23]。美国临床肿瘤学会(ASCO)指南推荐持续恶心需要每日接受止吐药物治疗,如果影响正常生活和(或)体重降低超过5%时,在排除其他原因后,需降低PARP抑制剂剂量[35]。
▲恶心和呕吐治疗方法:服用PARP抑制剂前30~60min清淡饮食有助于防止呕吐,避免进食刺激性食物,服药后多量饮水也可减轻恶心、呕吐反应。另外,睡前服用PARP抑制剂也有助于减少恶心、呕吐的发生[36],也可以预防性使用5-羟色胺拮抗剂,并持续每日使用,同时需注意可能引起的便秘发生。如果出现突发性恶心、呕吐症状,可以依次添加不同类别的止吐药,包括胃复安、劳拉西泮、吩噻嗪、地塞米松、氟哌啶醇、奥氮平、大麻素等。此外,应考虑在后续治疗中增加预防性止吐治疗。如果在最初治疗的几个周期内恶心消退或没有发生,可以减少和停止止吐药治疗。如果出现3级或4级恶心,在恢复至1级或更好之后,再开始PARP治疗,剂量可同前,也可以减量或调整预防恶心、呕吐的措施[37]。
2.2.1.2 腹泻 腹泻也是PARP抑制剂的常见不良反应,发生率约为<10%~33%,≥3级发生率≤3.5%。奥拉帕利总体发生率为24%~33%,3~4级发生率为1.0%~3.0%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为19.1%,3~4级发生率为0.3%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为13.6%,3~4级腹泻未见报道;氟唑帕利总体发生率小于10%,3~4级腹泻未见报道;帕米帕利1~4级发生率为22.1%,3~4级发生率为3.5%。腹泻严重程度会随着时间推移逐渐减轻。轻度至中度腹泻可以通过补充水分、调整饮食和(或)止泻药物(如洛哌丁胺)干预。严重腹泻应服用止泻药物(含或不含益生菌)、静脉输液以及补充电解质。发生感染的患者需要抗生素治疗。经上述干预措施仍未得到控制的腹泻,可以考虑增加或改用另一种口服止泻药,如果腹泻时间过长,可能需要中断或减少PARP抑制剂剂量[27,35]。
2.2.1.3 便秘 发生率≤39.8%,≥3级发生率≤1%。奥拉帕利总体发生率为21%~28%,3级以上未见报道;氟唑帕利未见便秘报道;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为39.8%,3~4级发生率为0.5%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为29.9%~33%,3~4级发生率为0.6%~1%;帕米帕利1~4级便秘发生率为8%,3~4级未见报道。轻中度便秘可使用乳果糖或开塞露等改善症状,对于直肠完全梗阻或粪便嵌塞,可通过栓剂和(或)灌肠治疗[27,35]。若便秘时间过长,建议减少PARP抑制剂使用剂量,待症状缓解后继续PARP抑制剂治疗。
2.2.1.4 食欲减退 发生率低于20%,≥3级发生率低于1%。可以通过改变食物温度、添加或改变调味料等策略改善食物味道,促进食欲。改善口腔卫生也可能有助于改善食欲,但目前没有针对味觉障碍的药物选择[37]。
2.2.2 疲劳 疲劳是PARP抑制剂常见的类效应之一,总体发生率为25.4%~63%,≥3级发生率≤8.2%。奥拉帕利总体发生率为42%~63%,3~4级发生率4.1%~7.4%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率为59.4%,3~4级发生率为8.2%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率为25.4%~48%,3~4级发生率为0.6%~3%;氟唑帕利总体发生率为57.5%~60.2%,3~4级发生率为0~0.6%;帕米帕利引起疲劳的总体发生率为29.2%,3~4级发生率为1.8%。随着使用时间延长,疲劳症状相应改善。
▲处理原则:患者每次就诊时应进行疲劳筛查,也建议患者监测和自我报告感知到的疲劳水平[37]。可以通过体力活动来缓解疲劳,如果同时存在与治疗相关的贫血或血小板减少症,需谨慎运动[38]。
▲治疗方法:首先,尽可能消除疲劳的相关诱因,如改善贫血、血小板减少等。可以通过活动缓解疲劳、乏力等症状,如散步、打太极等[38-39]。按摩疗法和心理咨询也有助于缓解疲劳,如正念治疗。此外,建立利于睡眠的环境,优化睡眠以及改善营养状况的治疗也有利于消除疲劳。如果仍然无法耐受,减量治疗或中断PARP抑制剂治疗,症状改善后再恢复治疗。有研究证明,哌醋甲酯5~20mg/d或人参2000mg/d可改善癌症相关疲劳,如有需要可以尝试使用[37]。
2.2.3 神经系统毒性 PARP抑制剂使用期间,有失眠和头痛的报道,失眠的总体发生率约为0~28.8%,≥3级失眠发生率<1%。奥拉帕利和帕米帕利尚无失眠报道;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率24.3%,3~4级发生率0.3%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率21%~28.8%,3~4级发生率0~0.6%;氟唑帕利总体发生率小于10%,3~4级失眠尚无报道。PARP抑制剂头痛的总体发生率为5.3%~25.9%,≥3级头痛发生率≤1%。奥拉帕利总体发生率为21%~25%,3~4级发生率0~1.0%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)总体发生率25.9%,3~4级发生率0.3%,个体化起始剂量用药人群(200或300mg,每日1次)总体发生率18.1%~22%,3~4级发生率0.6%~1%;氟唑帕利总体发生率小于10%,3~4级头痛未见报道;帕米帕利总体发生率为5.3%,3~4级头痛未见报道。PARP抑制剂神经系统毒性可能与PARP1参与了昼夜节律基因转录的调节有关[40]。在出现神经系统不良反应时,需排除其他原因,如中枢神经系统受累、内分泌异常等。建议在专科医生的指导下对患者进行睡眠教育、认知行为治疗和药物治疗[41]。
▲失眠的处理原则:首先是针对病因的治疗,在抗肿瘤治疗同时,尽可能对失眠症状给予必要处理。应当在病因治疗和非药物治疗措施的基础上酌情给予相应的镇静催眠药物,同时药物选择和剂量也需遵循个体化原则,从小剂量开始给药,逐步增加到有效剂量并维持[42]。
▲失眠的治疗方法:失眠的治疗包括药物治疗和非药物治疗。非药物治疗可以采取睡眠卫生教育、松弛疗法、刺激控制疗法和睡眠限制疗法。药物治疗可选择镇静催眠药物和苯二氮卓类药物短期应用,如苯二氮卓类药物劳拉西泮、艾司唑仑和非苯二氮卓类镇静安眠药物如唑吡坦、佐匹克隆,右佐匹克隆。一些抗抑郁药物和褪黑素受体激动剂,以及具有镇静作用的非典型抗精神病药也可以选择应用,而且一般可以长期连续应用[42]。
▲头痛的处理原则:首先是针对病因的治疗,在抗肿瘤治疗同时,尽可能对头痛症状给予必要处理。应当在病因治疗和非药物治疗措施的基础上,根据患者疼痛程度,有针对性的选用不同性质和作用强度的镇痛药物,个体化调整镇痛药物剂量和给药频率[23,43]。
▲头痛的治疗方法:轻度疼痛可选用非甾体类抗炎药物(NSAID);中度疼痛可选用弱阿片类药物或低剂量的强阿片类药物,并可联合应用非甾体类抗炎药物以及辅助镇痛药物(镇静剂、抗惊厥类药物和抗抑郁类药物等)。重度疼痛:首选强阿片类药,并可合用非甾体类抗炎药物以及辅助镇痛药物(镇静剂、抗惊厥类药物和抗抑郁类药物等)。对使用止痛药的患者要加强监护,密切观察其疼痛缓解程度和机体反应情况,并注意药物联合应用时的药物相互作用。症状缓解后撤除镇痛药物,使用阿片类药物的患者应该逐渐减量,直至停药[43]。
不同PARP抑制剂的临床研究中均未报告过手脚麻木,但在临床中偶见患者服用PARP抑制剂后出现手脚麻木的情况,鉴于紫杉类药物广泛存在神经毒性,患者常出现手足疼痛和麻木等周围神经毒性症状,建议在患者使用PARP抑制剂之前应先咨询患者是否使用过紫杉醇,并对患者进行相应教育,如服用PARP抑制剂后出现手脚麻木的情况,可用温水泡手、泡脚,戴手套、穿保暖鞋,避免因寒冷导致麻木加重,也可以应用营养神经药物治疗,如甲钴胺片和B族维生素类药物治疗。
2.2.4 心血管毒性 PARP抑制剂对心血管系统的影响包括血压升高和心悸。尼拉帕利固定起始剂量用药人群(300mg,每日1次)高血压总体发生率19.3%,心悸总体发生率10.4%,3~4级高血压发生率为8.2%,3~4级心悸未见报道,个体化起始剂量用药人群(200或300mg,每日1次)高血压总体发生率11.3%~17%,心悸总体发生率为18.1%,3~4级高血压发生率1.1%~5%,3~4级心悸发生率为0.6%;氟唑帕利高血压发生率为6.2%,3~4级发生率为4.4%;其他PARP抑制剂未见心血管毒性报道。心血管毒性的发生机制可能由于PARP抑制剂与5-羟色胺、去甲肾上腺素和多巴胺转运蛋白结合,导致这3种物质在突触间隙的再摄取受到干扰而浓度上升,仅有少于1%的患者因高血压退出治疗。
PARP抑制剂的心血管系统的不良反应大多较轻微,通常发生在治疗的早期,通过对症处理或剂量调整后,绝大部分患者都可继续PARP抑制剂治疗。建议治疗前,充分控制已存在的高血压,然后再开始使用PARP抑制剂治疗,服药第1年内每月监测血压、心率,并在治疗后定期监测,特别是有心血管疾病史的患者,鼓励患者自行规律监测。如果确诊高血压,应考虑非药物或药物降压治疗,并根据严重程度选择降压药物,首选噻嗪类、血管紧张素转换酶抑制剂(ACEI)/血管紧张素受体阻滞剂(ARB)或长效二氢吡啶钙通道阻滞剂(CCB),如单药控制不佳,则考虑联合治疗。如有必要,可考虑中断PARP抑制剂治疗,并根据产品说明书中的建议调整剂量。需要注意的是,CCB类药物通常经过细胞色素酶P450进行代谢,又是最常用的抗高血压药物之一,与目前PARP抑制剂中的奥拉帕利、氟唑帕利、帕米帕利等可能存在药物相互作用,具有潜在的毒性增加风险,需注意评估。卵巢癌患者高血压的管理需要注重MDT,以保证抗肿瘤靶向药物及心血管药物的合理应用。
心悸往往由心动过速所致,可以短阵发作,也可以持续存在,持续存在者主要针对病因采用最佳治疗[44],症状明显者可考虑单用伊伐布雷定或联合β受体阻滞剂治疗;未伴有射血分数降低型心力衰竭(HFrEF)的患者亦可考虑使用非二氢吡啶钙通道阻滞剂治疗[45]。
2.2.5 其他少见毒性 由于PARP抑制剂可以干扰DNA修复途径[46],这可能诱发严重的AML/MDS。临床研究显示,PARP抑制剂导致的AML/MDS发生率约为1%,所有发生MDS和AML的患者都曾接受过含铂化疗药物和(或)其他DNA损伤药物治疗[47]。美国FDA建议患者在使用PARP抑制剂前后每月进行全血细胞计数检测。如果发现原因不明或持续的全血细胞减少[48],应转诊至血液科,排除营养缺乏或病毒感染等其他原因,如确诊AML/MDS应立即停药,进行AML/MDS治疗。
PARP抑制剂治疗的患者中,有10%~20%可能发生呼吸道毒性,表现为呼吸困难、咳嗽或鼻咽炎。奥拉帕利呼吸困难总体发生率为0~15%,3~4级为0~1.0%;咳嗽总体发生率16%~22%,3~4级为0~0.5%;鼻咽炎总体发生率0~15%,无3级以上不良反应发生。尼拉帕利呼吸系统毒性发生率7.9%~20.9%,3~4级发生率为0~0.4%;呼吸困难总体发生率为18.2~19.3%%,3~4级发生率为0.4%~1.1%;上呼吸道感染总体发生率为10.1%~20.9%,3~4级发生率为0~0.8%;鼻咽炎总体发生率7.9%~11.2%,无3级以上不良反应发生;咳嗽总体发生率11.9%~15.3%,无3级以上不良反应发生。氟唑帕利呼吸困难、肺部炎症、咳痰的发生率均小于10%。帕米帕利呼吸困难总体发生率为5.3%,无3级以上不良反应发生。临床需对呼吸道毒性进行全面的症状评估,并治疗其他潜在合并症。呼吸困难的患者可以适当减少剧烈的体力活动,并有一定的休息时间。如果发现新发或进一步加重的肺部症状,应暂停治疗并进行诊断性检查,以排除肺炎等,必要时进行肺功能检查和支气管镜检查等,并酌情启动糖皮质激素和抗生素治疗。如检查中未发现异常且症状缓解,可考虑重新开始PARP抑制剂治疗。
背痛和关节痛偶有发生,总体发生率<35%,≥3级发生率<0.5%。奥拉帕利背痛总体发生率为11.3%,关节痛发生率为14.9%;尼拉帕利固定起始剂量用药人群(300mg,每日1次)背痛总体发生率13.4%, 3~4级发生率为0.5%,个体化起始剂量用药人群(200或300mg,每日1次)背痛总体发生率7.9%, 无3级以上不良反应发生,关节痛总体发生率为11.3%~17.6%,3~4级为0.3%~0.4%;氟唑帕利未见背痛和关节痛报道;帕米帕利背痛总体发生率6.2%,无3级以上不良反应发生。如果疼痛难忍,可根据镇痛药物的镇痛等级,选择药物治疗。
此外,氟唑帕利可能导致色素沉着。出现皮肤相关症状后,对症处理即可,注意防晒并做好皮肤保湿,如果无明显改善或影响睡眠,可口服抗组胺药物;以夜间症状为主者可选择氯苯那敏、赛庚啶、多塞平和西替利嗪等药物;日夜无明显区别者可选择氯雷他定和依巴斯汀等药物。如有必要,可转诊至皮肤科[23]。
3 PARP抑制剂不良反应的中医管理
中医学基于辩证论治理论,以整体观念和辨证施治为基本特点,涵盖日常生活调护、情志调理等方法具有一定的特色优势,在减轻癌症患者痛苦、提高生活质量等方面具有显著的作用。
中医认为骨髓抑制属于“血虚”、“虚劳”等范畴,属阴阳、气血、脏腑之虚,尤以脾肾两虚为主。所以在骨髓抑制阶段,应以健脾补肾、补气升血、养阴生津等为治疗原则。内治经典方剂:四物汤、当归补血汤、八珍汤。成药:升红颗粒、芪胶升白胶囊、升血小板胶囊、健脾益肾颗粒。外治:针灸选取大椎、双膈俞、双肾俞、双足三里治疗5d,可增强骨髓造血功能[49]。或艾灸选择足三里、脾俞、胃俞、膈俞、关元等,证实了胃气得充则气血生化有源[50]。
中医认为消化道毒性的恶心呕吐与脾气虚、胃失和降或湿阻中焦有关。药物所致消化系统不良反应属于“药邪”,多为寒凉,进入体内可导致中阳不足、升降失职、脾胃气机不畅,上逆作呕;或寒凉药物损伤脾胃,导致脾失健运,湿从内生,阻滞气机而致恶心呕吐。生姜片嚼服联合腹部神阙隔姜灸可减轻恶心、呕吐症状。藿香正气软胶囊也可减轻药物引起的呕吐。
中医认为肿瘤相关疲劳属于“气虚”范畴,肿瘤侵犯导致脏腑气血阴阳失衡、正气虚弱;另一方面,药物偏性损伤人体正气,造成脏腑气血亏虚。此外,气血之间同源互化,互根互用。气虚可致血虚,导致气血两虚,出现疲劳与贫血,对于肿瘤相关疲劳可选择人参、补中益气颗粒、四君子汤等。
针对心血管毒性,稳心颗粒有助于稳定心率[51],天麻钩藤饮是中药治疗高血压的经典方,可作为合并高血压患者的辅助治疗药物[52]。
4 营养
医学营养治疗是肿瘤综合治疗措施之一,临床营养师是MDT成员之一,通过给患者及其家属规范的营养教育和干预指导,对改善患者预后,提高生活质量具有重要的作用。建议肿瘤患者能量摄入与正常人标准相同,适当提高蛋白质摄入,脂肪摄入量不超过总能量30%,按照《中国居民膳食营养素参考摄入量》摄入维生素和矿物质。考虑到部分患者发生药物相关不良反应,贫血的患者可适当补充富含铁及维生素C的食物;发生消化道不良反应的患者可避免食用气味较为浓烈的食物,以清淡、易消化的食物为主。伴呕吐和腹泻的患者需额外补充水分,避免脱水。
随着人们饮食的多样性和广泛性,食物对药物的药代动力学和药效动力学的影响不容忽视,特别要注意CYP3A酶强抑制或诱导作用的食物[53-54]。主要经CYP3A酶代谢的PARP抑制剂(奥拉帕利和氟唑帕利)应避免食用CYP3A酶中、强抑制作用的食物,如西柚、西柚汁、酸橙、酸橙汁。帕米帕利主要代谢途径为CYP2C8和CYP3A,与强、中、轻效CYP3A抑制剂合用无需调整剂量,但也需要尽量避免与对CYP2C有抑制作用的石榴汁、大蒜和辣椒同服,以减少这类食物对帕米帕利药效学影响的风险。
【参考文献】:
[1]International Agency for Research on Cancer.China Source:Globocan 2020[EB/OL].https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf.
[2]Lheureux S,Braunstein M,Oza AM.Epithelial ovarian cancer:evolution of management in the era of precision medicine[J].CA Cancer J Clin,2019,69(4):280-304.
[3]鹿欣,姜洁,李宁,等.卵巢癌PARP抑制剂临床应用指南[J].中国医学前沿杂志,2020,12(5):29-37.
[4]Jain PG,Patel BD. Medicinal chemistry approaches of poly ADP-Ribose polymerase 1(PARP1)inhibitors as anticancer agents-a recent update[J].Eur J Med Chem,2019,165:198-215.
[5]Ashworth A,Lord CJ.Synthetic lethal therapies for cancer:what's next after PARP inhibitors?[J].Nat Rev Clin Oncol,2018,15(9):564-576.
[6] Lightfoot M,Montemorano L,Bixel K.PARP inhibitors in gynecologic cancers:what is the next big development?[J].Curr Oncol Rep,2020,22(3):29.
[7]Curtin NJ,Szabo C.Poly(ADP-ribose)polymerase inhibition:past,present and future[J].Nat Rev Drug Discov,2020,19(10):711-736.
[8]Mittica G,Ghisoni E,Giannone G,et al. PARP inhibitors in ovarian cancer[J].Recent Pat Anticancer Drug Discov,2018,13(4):392-410.
[9]Lee A.Fuzuloparib:first approval[J].Drugs,2021,81(10):1221-1226.
[10]Wang H,Ren B,Liu Y,et al.Discovery of pamiparib(BGB-290),a potent and selective poly(ADP-ribose)polymerase(PARP)inhibitor in clinical development[J].J Med Chem,2020,63(24):15541-15563.
[11]Staropoli N,Ciliberto D,Del Giudice T,et al.The era of PARP inhibitors in ovarian cancer:"Class Action" or not? A systematic review and meta-analysis[J].Crit Rev Oncol Hematol,2018,131:83-89.
[12]Moore K,Colombo N,Scambia G,et al.Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer[J].N Engl J Med,2018,379(26):2495-2505.
[13]Pujade-Lauraine E,Ledermann JA,Selle F,et al.Olaparib tablets as maintenance therapy in patients with platinum-sensitive,relapsed ovarian cancer and a BRCA1/2 mutation(SOLO2/ENGOT-Ov21):a double-blind,randomised,placebo-controlled,phase 3 trial[J].Lancet Oncol,2017,18(9):1274-1284.
[14]Ledermann J,Harter P,Gourley C,et al.Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer[J].N Engl J Med,2012,366(15):1382-1392.
[15]Mirza MR,Monk BJ,Herrstedt J,et al.Niraparib maintenance therapy in platinum-sensitive,recurrent ovarian cancer[J].N Engl J Med,2016,375(22):2154-2164.
[16]Wu XH,Zhu JQ,Yin RT,et al.Niraparib maintenance therapy in patients with platinum-sensitive recurrent ovarian cancer using an individualized starting dose(NORA):a randomized,double-blind,placebo-controlled phase Ⅲ trial[J]. Ann Oncol,2021,32(4):512-521.
[17]González-Martín A,Pothuri B,Vergote I,et al.Niraparib in patients with newly diagnosed advanced ovarian cancer[J]. N Engl J Med,2019,381(25):2391-2402.
[18]Li N,Bu H,Liu J,et al.An open-label,multicenter,single-arm,phase Ⅱ study of fluzoparib in patients with germline BRCA1/2 mutation and platinum-sensitive recurrent ovarian cancer[J]. Clin Cancer Res,2021,27(9):2452-2458.
[19]Li N,Zhang YZ,Wang J,et al.Fuzuloparib maintenance therapy in patients with platinum-sensitive,relapsed ovarian cancer:a multicenter,randomized,double-blind,placebo-controlled,phase Ⅲ trial[J].Gynecol Oncol,2021,162(S1):2.
[20]Wu X,Zhu J,Wang J,et al.820P Phase Ⅱ study of pamiparib in Chinese patients(pts)with advanced ovarian cancer(aOC)[J].Annals of Oncology,2020,31(Supl.4):S619-S620.
[21]Voskoboynik M,Mileshkin L,Gan H,et al.Safety,antitumor activity,and pharmacokinetics(PK)of pamiparib(BGB-290),a PARP1/2 inhibitor,in patients(pts)with advanced solid tumours:updated phase I dose-escalation/expansion results[J].Ann Oncol,2019,30(Supl.5):v167.
[22]Sun T,Shi YX,Cui JW,et al.A phase 2 study of pamiparib in the treatment of patients with locally advanced or metastatic HER2-negative breast cancer with germline BRCA mutation[J].J Clin Oncol,2021,39(15):1087.
[23]Madariaga A,Bowering V,Ahrari S,et al.Manage wisely:poly(ADP-ribose)polymerase inhibitor(PARPi)treatment and adverse events[J].Int J Gynecol Cancer,2020,30(7):903-915.
[24]Hopkins TA,Ainsworth WB,Ellis PA,et al.PARP1 trapping by PARP inhibitors drives cytotoxicity in both cancer cells and healthy bone marrow[J].Mol Cancer Res,2019,17(2):409-419.
[25]Farrés J,Martín-Caballero J,Martínez C,et al.Parp-2 is required to maintain hematopoiesis following sublethal γ-irradiation in mice[J].Blood,2013,122(1):44-54.
[26]Farrés J,Llacuna L,Martin-Caballero J,et al. PARP-2 sustains erythropoiesis in mice by limiting replicative stress in erythroid progenitors[J].Cell Death Differ,2015,22(7):1144-1157.
[27]Lorusso D,García-Donas J,Sehouli J,et al.Management of adverse events during rucaparib treatment for relapsed ovarian cancer:a review of published studies and practical guidance[J].Target Oncol,2020,15(3):391-406.
[28]中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会.中国肿瘤化疗相关贫血诊治专家共识(2019年版)[J].中国肿瘤临床,2019,46(17):869-875.
[29]De Botton S,Sabri S,Daugas E,et al.Platelet formation is the consequence of caspase activation within megakaryocytes[J].Blood,2002,100(4):1310-1317.
[30]中华医学会内科学分会,王建祥,张奉春,等.中国成人血小板减少症诊疗专家共识[J].中华内科杂志,2020,59(7):498-510.
[31]中国临床肿瘤学会肿瘤化疗所致血小板减少症共识专家委员会.肿瘤化疗所致血小板减少症诊疗中国专家共识(2018版)[J].中华肿瘤杂志,2018,40(9):714-720.
[32]National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines®)for Hematopoietic Growth Factors[EB/OL].https://www.nccn.org/professionals/physiciangls/pdf/growthfactors.pdf.[2021-10-18].
[33]Ponath V,Heylmann D,Haak T,et al.Compromised DNA repair and signalling in human granulocytes[J].J Innate Immun,2019,11(1):74-85.
[34]Smith TJ,Bohlke K,Lyman GH,et al.Recommendations for the use of WBC growth factors:American Society of Clinical Oncology clinical practice guideline update[J].J Clin Oncol,2015,33(28):3199-3212.
[35]Tew WP,Lacchetti C,Ellis A,et al.PARP inhibitors in the management of ovarian cancer:ASCO guideline[J].J Clin Oncol,2020,38(30):3468-3493.
[36]中国抗癌协会妇科肿瘤专业委员会.中国卵巢上皮性癌维持治疗指南(2021年版)[J].中国实用妇科与产科杂志,2021,37(6):640-649.
[37]Gunderson CC,Matulonis U,Moore KN.Management of the toxicities of common targeted therapeutics for gynecologic cancers[J].Gynecol Oncol,2018,148(3):591-600.
[38]National Comprehensive Cancer Network.Cancer-related fatigue,Version 1.2021[EB/OL].https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physiciagls/pdf/fatigue.pdf.[2021-10-18].
[39]Fabi A,Bhargava R,Fatigoni S,et al.Cancer-related fatigue:ESMO clinical practice guidelines for diagnosis and treatment[J]. Ann Oncol,2020,31(6):713-723.
[40]Zhao H,Sifakis EG,Sumida N,et al.PARP1- and CTCF-mediated interactions between active and repressed chromatin at the Lamina promote oscillating transcription[J].Mol Cell,2015,59(6):984-997.
[41]National Comprehensive Cancer Network.NCCN clinical practice guidelines in oncology:adult cancer pain.Version 2,2021[EB/OL].https://www.nccn.org/guidelines/guidelinesdetail?category=3&id=1413.[2021-10-18].
[42]唐丽丽,詹淑琴,于恩彦,等.成人癌症患者失眠诊疗专家建议[J].中国心理卫生杂志,2021,35(6):441-448.
[43]中华人民共和国国家卫生健康委员会.癌症疼痛诊疗规范(2018年版)[J].临床肿瘤学杂志,2018,23(10):937-944.
[44]郑黎晖.欧洲心律协会2011年心悸诊疗专家共识解读[J].心血管病学进展,2012,33(2):161-163.
[45]Calkins H.The 2019 ESC guidelines for the management of patients with supraventricular tachycardia[J].Eur Heart J,2019,40(47):3812-3813.
[46]Lord CJ,Ashworth A.PARP inhibitors:synthetic lethality in the clinic[J].Science,2017,355(6330):1152-1158.
[47]Morice PM,Leary A,Dolladille C,et al.Myelodysplastic syndrome and acute myeloid leukaemia in patients treated with PARP inhibitors:a safety meta-analysis of randomised controlled trials and a retrospective study of the WHO pharmacovigilance database[J].Lancet Haematol,2021,8(2):e122-e134.
[48]中华医学会血液学分会.骨髓增生异常综合征中国诊断与治疗指南(2019年版)[J].中华血液学杂志,2019,40(2):89-97.
[49]路玫,付雪鸽,滕迎春,等.针灸对环磷酰胺化疗小鼠骨髓细胞Notch信号通路差异基因蛋白表达的影响[J].中华中医药学刊,2019,37(5):1031-1034.
[50]徐红达,贾英杰,陈军,等.艾灸治疗化疗所致骨髓抑制的现状及经穴分析[J].肿瘤,2014,34(6):564-568.
[51]顾永军.稳心颗粒治疗心律失常的有效性和安全性分析[J].中国急救医学,2018,38(z2):120.
[52]王淼,郑贵森,陈也佳,等.天麻钩藤饮防治原发性高血压的研究现状[J].中国临床药理学杂志,2021,37(11):1455-1458.
[53]任夏洋,丛明华.食物与药物的相互作用[J].肿瘤代谢与营养电子杂志,2019,6(1):7-12.
[54]章冉冉,阳国平,荆宁宁,等.食物对细胞色素P450药物代谢酶的影响[J].中国临床药理学与治疗学,2014,19(2):200-206.
|



